Badanie fragmentacji DNA plemników metodą SCSA na cytometrze przepływowym
3 stycznia 2019Badanie uszkodzeń struktur DNA plemników znane jest w świecie medycznym od lat, jednak wciąż w wielu przypadkach u pacjentów zlecane są jedynie ogólne badania nasienia, takie jak ocena koncentracji plemników, ich liczby, ruchliwości czy morfologii. Zarówno wiele starszych jak i nowych publikacji naukowych sugeruje, by ocenę fragmentacji DNA plemników włączyć do diagnostyki męskiej płodności. Dlaczego? Ponieważ ilość procentowej zawartości uszkodzeń DNA plemników jest jednym z kluczowych czynników mających wpływ na zapłodnienie i rozwój zarodka. Im więcej uszkodzeń, tym gorsza jakość męskich komórek rozrodczych. Im jest ich mniej, tym szansa na uzyskanie upragnionej, prawidłowej ciąży jest większa. Plemnik posiadający liczne uszkodzenia w DNA może być zdolny do zapłodnienia komórki jajowej, jednak uszkodzone DNA będzie miało negatywny wpływ na rozwój zarodka i płodu, a także zdrowie potomstwa w przyszłości.
Dlaczego więc badanie to nie jest wykonywane częściej? Być może jest to związane z utrudnioną dostępnością do tego testu, zbyt długim okresem oczekiwania na wynik w niektórych przypadkach czy też poprawnym wykonaniem badania na etapie laboratoryjnym, co nierozerwalnie połączone jest z wiarygodnością wyniku.
Na rynku diagnostyczno-naukowym dostępnych jest kilka rodzajów testów oceniających integralność DNA w plemnikach. Do najczęściej stosowanych zaliczamy test COMET, test TUNEL, test SCD (ang. sperm chromatin dispersion) oraz test SCSA (ang. Sperm Chromatin Structure Assay). Spośród nich, w rutynowej diagnostyce pacjentów najczęściej dostępne są dwa modele oceny uszkodzeń DNA w plemnikach – metoda mikroskopowa SCD oraz cytometryczna SCSA. Badanie uszkodzeń DNA metodą SCSA jest testem, który odznacza się wysoką czułością i wiarygodnością. Podczas gdy w mikroskopie świetlnym badanych jest zwykle najwyżej kilkaset plemników, metoda cytometrii umożliwia sprawdzenie kilku tysięcy komórek. Pomiar cytometrem przepływowym dokonywany jest dwukrotnie, a analizie podlega 10 tysięcy plemników. Badanie można wykonać zarówno ze świeżego materiału jak i z rozmrożonej porcji nasienia. Do każdej próbki nasienia, po jej wstępnym przygotowaniu, dodawany jest roztwór o bardzo niskim pH, który dziurawi błonę komórkową plemników. Następnie do badanego materiału dodaje się specjalny barwnik – oranż akrydyny, który wnika przez powstałe otwory i łączy się z DNA komórki. Jeżeli w plemniku struktura nici DNA jest prawidłowa, barwnik wysyła zielone światło fluorescencyjne. Gdy nić DNA jest pojedyncza, czyli uszkodzona, emitowane jest światło czerwone. Odczyt dokonywany na cytometrze pozwala bardzo wyraźnie oddzielić oba te świecenia i w ten sposób uzyskać czytelny wynik. Oranż akrydyny jest barwnikiem fluorescencyjnym, który w zależności od miejsca połączenia się ze strukturami DNA będzie emitował fale o różnej długości. Te dwa rodzaje świecenia odczytywane są przez filtry i detektory cytometru. W przypadku fluorescencji czerwonej jest to filtr odczytujący fale o długości 630 nm, a przy zielonej filtr zbierający sygnały w pasmach od 515 do 530 nm.
Dodatkowo, dzięki metodzie cytometrycznej można ocenić tzw. dojrzałość chromatyny plemnikowej (HDS, ang. High DNA Stainability). Plemniki z niedojrzałą chromatyną plemnikową to takie które w metodzie cytometrycznej barwią się najsilniej (i najsilniej „świecą”). W jądrach komórkowych tych plemników DNA nie jest dostatecznie mocno „upakowane” (pomimo, że nie jest pofragmentowane) tak jak w plemnikach prawidłowych, więc tym samym plemniki z tej populacji nie są w pełni zdolne do zapłodnienia komórki jajowej. W badaniu cytometrycznym zakres HDS jest ustalany w oparciu o próbki referencyjne i powinien wynosić < 15%.
Zakresy referencyjne stosowane w metodzie SCSA dla DFI (fragmentacji DNA plemników) wyglądają następująco:
* 0% – 15% – bardzo wysoki potencjał do zapłodnienia
* 16% – 29% – średni potencjał do zapłodnienia
* powyżej 30% – bardzo niski potencjał do zapłodnienia
Jeżeli „tylko” około 30% plemników ma uszkodzoną strukturę DNA, to dlaczego pozostałe 70% nie jest zdolne do prawidłowego zapłodnienia komórki jajowej? Autorzy metody sugerują tutaj fenomen góry lodowej – fizyczno-chemiczne oddziaływania odczynników na plemniki są wystarczające jedynie do ujawnienia się 30% uszkodzonych komórek. Jest jednak wysoce prawdopodobne, że ten sam typ uszkodzeń występuje w całej populacji plemników, w mniejszym nasileniu, ale nadal wystarczającym, by powodować problemy z płodnością. Stąd też, przy wysokim procencie uszkodzeń w DNA częste są trudności z naturalnym zajściem w ciążę, obserwuje się obumieranie zarodków przy procedurach IVF, a w przypadku zapłodnienia – dochodzi do poronień na wczesnym etapie ciąży.
Warto więc pomyśleć nad włączeniem testu fragmentacji DNA plemników do rutynowej diagnostyki pacjentów, nawet wtedy, gdy wyniki ogólnych badań nasienia nie sugerują żadnych nieprawidłowości. Warto również wybrać metodę badania, która da lekarzowi prowadzącemu wiarygodne, przydatne informacje do dalszego postępowania leczniczego.
Przykładowe wyniki:
Wynik nieprawidłowy (bardzo wysokie DFI – 82,2%)
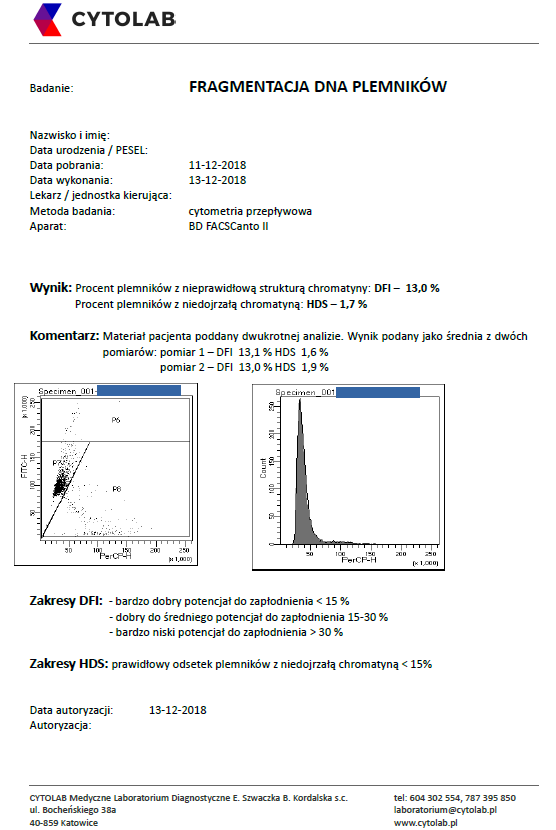
Wynik prawidłowy (DFI -13%)
Wyżej prezentowane wyniki zawierają wykresy cytometryczne analizowanego materiału pacjenta. Wykres z lewej strony wyniku to tzw. „dot plot”, wykres od prawej to histogram.
Na „dot plocie” przedstawione są populacje plemników z prawidłowym i nieprawidłowym DNA rozdzielone na podstawie emisji fal świecenia oranżu akrydyny. Populacja komórek położona wzdłuż osi Y powinna być jak największa – do pewnej wysokości jest to populacja plemników z prawidłowym DNA (plemniki położone powyżej głównej populacji prawidłowych to plemniki z niedojrzałym DNA). Komórki położone wzdłuż osi X są plemnikami z uszkodzonym DNA. Im jest ich więcej, tym fragmentacja plemników większa.
Pierwszy z prezentowanych wyników obrazuje wynik pacjenta z DFI nieprawidłowym, natomiast wynik drugi z DFI w zakresie normy.
Histogram jest wykresem tworzonym na podstawie „dot plotów”. Obrazuje to samo, tylko w postaci pików.
Opracowanie:
mgr Barbara Kordalska, diagnosta laboratoryjny
mgr Edyta Kruzel-Szwaczka, specjalista z laboratoryjnej diagnostyki medycznej
Laboratorium CYTOLAB