Rola antyoksydantów w leczeniu niepłodności u mężczyzn
15 stycznia 2013
Streszczenie
Stres oksydacyjny spowodowany jest zachwianiem równowagi między wytwarzaniem tzw. reaktywnych form tlenu (RFT) a działaniem ochronnego systemu antyoksydacyjnego odpowiedzialnego za ich neutralizowanie i usuwanie. Nadmiar RFT powoduje występowanie reakcji patologicznych prowadzących do uszkodzenia komórek i tkanek. Plemniki są szczególnie wrażliwe na szkodliwe działanie RFT. Stres oksydacyjny uszkadza ich czynność, powoduje uszkodzenia strukturalne DNA i przyśpiesza apoptozę, a konsekwencją jest ich zmniejszona liczebność oraz zaburzenie czynności, spadek ruchliwości i nieprawidłowa morfologia. Prowadzi to do niemożności uzyskania zapłodnienia lub zaburzenia rozwoju zarodka. Główne komórkowe źródła RFT w nasieniu to niedojrzałe plemniki i leukocyty. Wzrost liczby leukocytów może być wynikiem stanu zapalnego, ale także działania szkodliwych czynników środowiskowych, długiej abstynencji seksualnej czy żylaków powrózków nasiennych. Ochronny system antyoksydacyjny w nasieniu składa się z czynników enzymatycznych, jak i nieenzymatycznych. Mikroelementy m.in. takie jak cynk, selen, miedź i chrom wchodzą w skład budowy wielu enzymów tego systemu. Do nieenzymatycznych antyoksydantów należą między innymi witaminy A, E, C i z grupy B, glutation i kwas pantotenowy. Wydaje się, że niedobór każdego z tych czynników może powodować obniżenie całkowitego potencjału antyoksydacyjnego. W badaniach in vitro i in vivo udowodniono korzystny wpływ na płodność wielu czynników o działaniu antyoksydacyjnym, dlatego polecane jest ich stosowanie jako terapii wspomagającej w leczeniu niepłodności u mężczyzn.
Wstęp
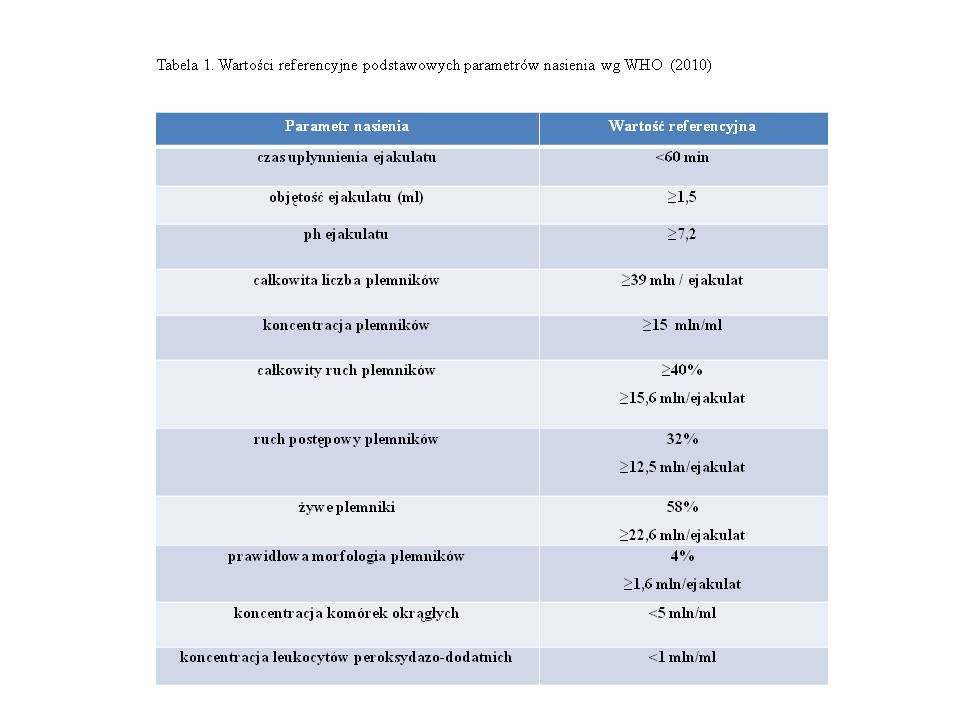
Światowa Organizacja Zdrowia (ang.: World Health Organization, WHO) definiuje niepłodność jako niemożność uzyskania ciąży w okresie 12 miesięcy regularnego współżycia pary w celach koncepcyjnych. Niepłodność dotyka 13-20% par w Polsce i na świecie, bez względu na rasę, czy1-4 przynależność etniczną . Ocenia się, że wśród par niepłodnych czynnik męski stanowi od 25% do nawet 50%2,5,6. Wartości referencyjne parametrów nasienia według WHO (2010) przedstawione są w tabeli 17.
 Chociaż wśród przyczyn męskiej niepłodności wyróżnić można nieprawidłowości anatomiczne, takie jak żylaki powrózka nasiennego, niedrożność dróg wyprowadzających nasienie, czy też zaburzenia neurologiczne ejakulacji, to jednak większość jej przypadków stanowią zaburzenia procesu spermatogenezy oraz czynności plemników1. Pomimo rozwoju nauki i coraz doskonalszych metod diagnostycznych w dalszym ciągu w części przypadków etiologia i patogeneza zaburzeń męskiej płodności pozostaje nieznana stanowiąc tzw. niepłodność idiopatyczną 8.
Chociaż wśród przyczyn męskiej niepłodności wyróżnić można nieprawidłowości anatomiczne, takie jak żylaki powrózka nasiennego, niedrożność dróg wyprowadzających nasienie, czy też zaburzenia neurologiczne ejakulacji, to jednak większość jej przypadków stanowią zaburzenia procesu spermatogenezy oraz czynności plemników1. Pomimo rozwoju nauki i coraz doskonalszych metod diagnostycznych w dalszym ciągu w części przypadków etiologia i patogeneza zaburzeń męskiej płodności pozostaje nieznana stanowiąc tzw. niepłodność idiopatyczną 8.
Niemały udział w zaburzeniu męskiej płodności przypisuje się czynnikom środowiskowym takim jak narażenie na działanie niektórych związków chemicznych, metali ciężkich, środków ochrony roślin, a także podwyższonej temperatury, czy promieniowania elektromagnetycznego9-11. Palenie tytoniu, nadużywanie alkoholu, przewlekły stres, otyłość, stany zapalne w męskim układzie płciowym są także powiązane z obniżeniem męskiej płodności12-15. Konsekwencją działania większości wymienionych czynników jest stres oksydacyjny.
Stres oksydacyjny spowodowany jest zachwianiem równowagi między wytwarzaniem tzw. reaktywnych form tlenu (RFT, ang.: reactive oxygen species, ROS) a działaniem ochronnego systemu antyoksydacyjnego odpowiedzialnego za ich neutralizowanie i usuwanie. Nadmiar RFT powoduje występowanie reakcji patologicznych prowadzących do uszkodzenia komórek i tkanek. Plemniki są szczególnie wrażliwe na szkodliwe działanie RFT, ponieważ ich błona komórkowa zawiera duże ilości nienasyconych kwasów tłuszczowych, które ulegają procesowi utleniania (peroksydacja lipidów), a w cytoplazmie jest mała koncentracja enzymów neutralizujących RFT. Proces utleniania lipidów prowadzi do utraty integralności błony komórkowej i wzrostu jej przepuszczalności, inaktywacji enzymów komórkowych, strukturalnego uszkodzenia DNA oraz śmierci (apoptozy) komórki16. Konsekwencją jest zmniejszona liczebność plemników oraz zaburzenie ich czynności, spadek ruchliwości i nieprawidłowa morfologia17-20.
Ocenia się, że u około 25% niepłodnych mężczyzn występuje w nasieniu podwyższony poziom RFT21-23 i często obniżenie zdolności antyoksydacyjnych nasienia24-26. Ostatnio na podstawie metaanalizy dotychczasowych badań wykazano, że ilość RFT w nasieniu istotnie statystycznie koreluje ze współczynnikiem zapłodnień. Sugeruje to, że poziom RFT w nasieniu jest ważnym predyktorem powodzenia zapłodnienia27. W związku z powyższym zasadnym wydaje się podejmowanie prób wspomagania leczenia niepłodności męskiej suplementacją związkami wykazującymi zdolność neutralizowania RFT, czyli tzw. antyoksydantami23,28. Mechanizm szkodliwego działania RFT przedstawiony jest na rycinie 1.
Źródła RFT w nasieniu Rycina 1: Źródła nadmiaru reaktywnych form tlenu (RFT) i jego niekorzystne działanie w męskim układzie płciowym.
Rycina 1: Źródła nadmiaru reaktywnych form tlenu (RFT) i jego niekorzystne działanie w męskim układzie płciowym.
Jednym z głównych komórkowych źródeł RFT w nasieniu są same plemniki29. Plemniki z tzw. przywieszką cytoplazmatyczną, świadczącą o ich niedojrzałości i obniżonym potencjale zapładniającym, wytwarzają większe ilości RFT niż plemniki o budowie prawidłowej30-32. Drugim źródłem RFT w nasieniu są leukocyty, które w warunkach fizjologicznych wytwarzają nawet do 1000 razy więcej RFT niż plemniki33,34. Taka wysoka produkcja RFT przez leukocyty odgrywa istotną rolę w mechanizmie obrony komórkowej w zakażeniach i stanach zapalnych. W takich przypadkach aktywowane leukocyty infiltrują zaatakowany narząd wydzielając duże ilości RFT, aby doprowadzić do eliminacji czynników infekcyjnych, ale przy niedostatecznej równowadze oksydantów i antyoksydantów mogą uszkadzać także własne komórki. Wzrost liczby leukocytów w nasieniu może być także wynikiem działania szkodliwych czynników środowiskowych, długiej abstynencji seksualnej czy żylaków powrózków nasiennych14,35.
System antyoksydacyjny w nasieniu
Ochronny system antyoksydacyjny w nasieniu składa się z czynników enzymatycznych, jak i nieenzymatycznych, które ściśle współdziałają z sobą w celu zapewnienia optymalnej ochrony przed RFT. Wydaje się, że niedobór każdego z nich może powodować obniżenie całkowitego potencjału antyoksydacyjnego.
Podstawowym antyoksydacyjnym systemem enzymatycznym w nasieniu jest tzw. triada enzymatyczna, do której zalicza się dysmutazy ponadtlenkowe, katalazę oraz peroksydazy glutationowe. Ważnym składnikiem budowy tych enzymów są mikroelementy, takie jak cynk, selen, miedź i mangan 36. Ich suplementacja przyczynia się do poprawy aktywności antyoksydacyjnego systemu enzymatycznego, zwłaszcza w przypadkach ich niedoboru, i poprzez to jakości nasienia.
Oprócz enzymów neutralizujących nadprodukcję RFT istotną rolę w antyoksydacyjnym systemie ochronnym odgrywają tzw. niskocząsteczkowe, nieenzymatyczne antyoksydanty, które wspomagają aktywność enzymów. Należą do nich między innymi glutation, kwas pantotenowy, witaminy A, E, C i z grupy B oraz mikroelementy, takie jak cynk, selen i miedź23,37. Ważnym mikroelementem wydaje się także chrom, który wchodzi w skład budowy wielu enzymów uczestniczących w gospodarce węglowodanowej. Jego suplementacja ogranicza odkładanie się tkanki tłuszczowej, a więc zapobiega otyłości, która prowadzi do inicjowania stanu zapalnego i stresu oksydacyjnego38 .
Nieenzymatyczne antyoksydanty
Karotenoidy to grupa organicznych związków chemicznych rozpuszczalnych w tłuszczach, które znajdują się głównie w żółtych, czerwonych, pomarańczowych i różowych barwnikach roślinnych. Są one prekursorami witaminy A (zbiorcza nazwa grupy retinoidów). W przewodzie pokarmowym powstaje z nich retinal, który następnie jest przekształcany do retinolu, najważniejszego składnika witaminy A. Karotenoidy należą do naturalnych przeciwutleniaczy, odpowiadają za integralność błon komórkowych, regulują proliferację komórek nabłonkowych, uczestniczą w regulacji spermatogenezy39. Ich niedobór w diecie może prowadzić do obniżenia parametrów nasienia 40.
Witamina E (tokoferol) jest organicznym związkiem chemicznym rozpuszczalnym w tłuszczach zlokalizowanym głównie w błonach komórkowych. Jej działanie antyoksydacyjne polega głównie na przerwaniu reakcji peroksydacji lipidów zapoczątkowanej przez RFT, a także na wychwytywaniu wolnych rodników hydroksylowych i nadtlenkowych. Tak więc witamina E głównie osłania składniki błony komórkowej plemników przed uszkodzeniem, a w mniejszym stopniu zmniejsza produkcję RFT. W badaniach in vitro wykazano, że witamina E przeciwdziała obniżeniu ruchliwości plemników, a ponadto poprawia ich zdolność do zapłodnienia w teście penetracji komórki jajowej chomika41. W badaniach in vivo, w terapii męskiej niepłodności suplementacja witaminą E okazała się skuteczna w przypadkach obniżenia liczby i ruchliwości plemników (oligoasthenozoospermii) spowodowanej stresem oksydacyjnym42,43. Jej podanie doustne znamiennie zwiększało ruchliwość plemników poprzez zmniejszenie produkcji plemnikowego dwualdehydu malonowego (MDA), który jest końcowym produktem peroksydacji lipidów, a tym samym pośrednim wskaźnikiem natężenia tego procesu w komórce44. Stwierdzono, że stężenie MDA w nasieniu jest dwukrotnie wyższe u mężczyzn z asthenozoospermią w porównaniu z mężczyznami z normozoospermią, a jego obniżenie dobrze koreluje z odsetkiem udanych prób uzyskania ciąż.
Jeszcze lepsze działanie witaminy E na ruchliwość plemników obserwowano przy jej łącznym podaniu z selenem43. Stwierdzono również, że sam selen przeciwdziała oksydacyjnemu uszkodzeniu DNA plemników. Selen jest niezbędnym mikroelementem dla prawidłowego rozwoju jąder, procesu spermatogenezy, ruchliwości i czynności plemników45. Brak selenu prowadzi do zaniku nabłonka plemnikotwórczego, zaburzeń spermatogenezy i dojrzewania plemników w najądrzach oraz zmniejszenia objętości jąder46. W nasieniu obserwuje się w takich stanach zwiększony odsetek plemników z nieprawidłową morfologią (głównie główki i wstawki) i gorszą ruchliwość plemników43. Nie tylko selen, ale także miedź i cynk są pierwiastkami śladowymi, które mają znaczenie dla prawidłowej czynności jąder m.in. spermatogenezy. Cynk jest składnikiem ponad 200 enzymów, które biorą udział w biosyntezie kwasów nukleinowych i białek oraz w podziałach komórkowych.Stężenia cynku, miedzi i selenu w plazmie nasienia korelują z jakością nasienia u mężczyzn 48-50. Witamina C (kwas askorbinowy) jest substancją rozpuszczalną w wodzie, której stężenie w plazmie nasienia jest ok. 10-krotnie wyższe niż w surowicy krwi. Witamina ta charakteryzuje się dużą siłą działania antyoksydacyjnego, a szczególnie chroni DNA plemników przed szkodliwym działaniem RFT51. Wykazano obniżone stężenie witaminy C w plazmie nasienia z asthenozoospermią i podwyższonym stężeniem RFT25 oraz zależną od dawki poprawę ruchliwości plemników, szczególnie u palaczy tytoniu52. Wydaje się, że suplementacja hydrofilną witaminą C i lipofilną witaminą E może działać synergistycznie korzystnie na plemniki redukując wpływ stresu oksydacyjnego53. Glutation jest najbardziej rozpowszechnionym i występującym w największej ilości tiolem wewnątrzkomórkowym (składnikiem zawierającym siarkę). Ma właściwości przeciwutleniające, które przejawiają się w odtwarzaniu w białkach grup tiolowych (-SH), które mogą być eliminowane podczas stresu oksydacyjnego. Glutation ponadto zabezpiecza błony komórkowe przed utlenianiem lipidów i przeciwdziała formowaniu wolnych form tlenu. Deficyt glutationu prowadzi do niestabilności wstawek plemników, co powoduje zaburzenie ich ruchliwości54.
Suplementacja glutationu u niepłodnych mężczyzn z jednostronnymi żylakami powrózków nasiennych lub zapaleniem w układzie moczowo-płciowym prowadziła do istotnej poprawy parametrów nasienia55. Prekursorem glutationu jest N-acetylocysteina, która także poprawia ruchliwość plemników i przeciwdziała oksydacyjnemu uszkodzeniu DNA plemników56. Czynnikiem podnoszącym poziom glutationu jest kwas pantotenowy, który dzięki temu także chroni tkanki przed stresem oksydacyjnym57.
Terapia antyoksydantami w idiopatycznej oligozoospermii
Idiopatyczna oligozoospermia (IO) to termin określający obniżoną liczebność plemników w nasieniu (<39 mln/ejakulat) o przyczynie, której nie można wykryć rutynowymi metodami diagnostycznymi. Często IO łączy się z pogorszeniem innych parametrów nasienia np. mniejszym odsetkiem ruchliwych plemników i plemników o prawidłowej morfologii. Zwykle pacjenci nie wykazują żadnych zaburzeń w badaniu przedmiotowym, a także w profilu hormonalnym. Stwierdzono, że przyczyną ok. 20% IO może być asymptomatyczna infekcja np. wirusem Herpes, Chlamydia trachomatis, Ureaplasma uralyticum. Przyczyną może być także polimorfizm receptora androgenowego61, estrogenowego62 czy też receptora LH63. Jednak wielu autorów podkreśla znaczenie czynników środowiskowych, takich jak zanieczyszczenie środowiska substancjami o działaniu estrogenopodobnym tzw. ksenoestrogenami. Ksenoestrogeny są substancjami o różnorodnej budowie chemicznej, innej niż naturalny estradiol, ale mające zdolność wiązania się z receptorami estrogenowymi i przez to częściowe naśladowanie ich działania m.in. antyandrogennego. Ich źródłem są pestycydy, rozpuszczalniki organiczne, detergenty, metale ciężkie, substancje stosowane do produkcji plastików (ftalany), niektóre kosmetyki, leki i wiele innych. Mają one szczególnie niekorzystne działanie na męski układ rozrodczy w okresie płodowym. Są przyczyną zaburzeń rozwoju męskiego układu płciowego, wnętrostwa, nowotworów jąder i niepłodności, głównie z powodu obniżenia zdolności do produkcji plemników. Oprócz chemicznych zanieczyszczeń środowiskowych męską płodność mogą obniżać czynniki związane ze stylem życia np. przewlekły stres, mała aktywność fizyczna, złe odżywianie, otyłość, stosowanie używek np. picie dużych ilości kawy, alkoholu, palenie papierosów11,64,65. We wszystkich tych sytuacjach stwierdzano podwyższenie stężenia RFT i obniżenie aktywności enzymatycznych i/lub nieenzymatycznych czynników antyoksydacyjnych.
Ze względu na to, że IO może być spowodowana wieloma czynnikami, których najczęściej nie można zidentyfikować dostępnymi metodami laboratoryjnymi, leczenie odbywa się często metodą „prób i błędów”. Eliminuje się w miarę możliwości szkodliwe czynniki środowiskowe i zaleca zmianę stylu życia. Ważne znaczenie ma w tej terapii stosowanie antyoksydantów, które pomagają w przywróceniu równowagi pomiędzy RFT i ochronnym systemem antyoksydacyjnym28.
Podsumowanie
W ciągu ostatnich 25 lat pojawiło się wiele prac doświadczalnych i klinicznych na temat patofizjologii stresu oksydacyjnego i jego wpływu na zaburzenia płodności u mężczyzn, ale także kobiet. Nie ma obecnie wątpliwości, że stres oksydacyjny uszkadza czynność plemników, powoduje uszkodzenia strukturalne ich DNA i przyśpiesza apoptozę, a konsekwencją tego jest niemożność uzyskania zapłodnienia lub brak rozwoju zarodka. W badaniach in vitro i in vivo udowodniono korzystny wpływ na plemniki, współczynnik ciąż oraz żywych urodzeń wielu czynników o działaniu antyoksydacyjnym. Tak więc, wydaje się w pełni zasadne zalecanie mężczyźnie i kobiecie starającym się o dziecko suplementacji diety preparatami o działaniu antyoksydacyjnym, a zwłaszcza w sytuacji, gdy do ciąży nie dochodzi w ciągu kilkunastu miesięcy starań.
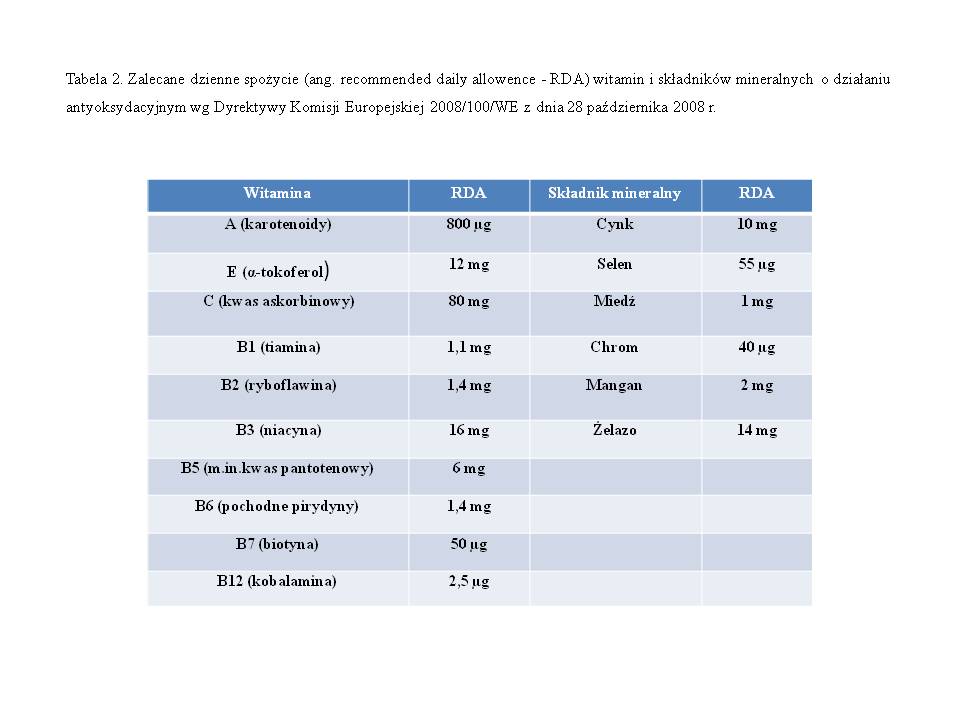
Dzienne zapotrzebowanie na te składniki przedstawione jest w tabeli nr 266. W przypadku stresu oksydacyjnego dawki preparatów antyoksydacyjnych powinny być 2-3-krotnie wyższe niż zalecane dzienne spożycie i u mężczyzn stosowane co najmniej przez 3 miesiące, bowiem czas rozwoju plemnika ze spermatogonii wynosi 72±4 dni.
 Autorki tekstu:
Autorki tekstu:
Jolanta Słowikowska-Hilczer (prof. dr hab. med.)
Renata Walczak-Jędrzejowska (dr n. med.)
Do pobrania broszura z całym artykułem: Broszura_antyoksydanty w diecie
Piśmiennictwo:
1. Hull M. G., Glazener C. M., Kelly N. J., [et al.] Population study of causes, treatment, and outcome of infertility. Br Med J (Clin Res Ed). 1985, 291, 1693-7.
2. Bablok L., Dziadecki W., Szymusik I., [et al.] Patterns of infertility in Poland – multicenter study. Neuro Endocrinol Lett. 2011, 32, 799-804.
3. Sanocka D. and Kurpisz M. Infertility in Poland–present status, reasons and prognosis as a reflection of Central and Eastern Europe problems with reproduction. Med Sci Monit. 2003, 9, SR16-20.
4. Irvine D. S. Epidemiology and aetiology of male infertility. Hum Reprod. 1998, 13 Suppl 1, 33-44.
5. Sharlip I. D., Jarow J. P., Belker A. M., [et al.] Best practice policies for male infertility. Fertil Steril. 2002, 77, 873-82.
6. Safarinejad M. R. Infertility among couples in a population-based study in Iran: prevalence and associated risk factors. Int J Androl. 2008, 31, 303-14.
7. WHO laboratory manual for the examination and processing of human semen. 5th edition, World Health Organization, Geneva, 2010.
8. Deng Y., Zhang W., Su D., [et al.] Some single nucleotide polymorphisms of MSY2 gene might contribute to susceptibility to spermatogenic impairment in idiopathic infertile men. Urology. 2008, 71, 878-82.
9. Lahdetie J. Occupation- and exposure-related studies on human sperm. J Occup Environ Med. 1995, 37, 922-30.
10. Thonneau P., Bujan L., Multigner L., [et al.] Occupational heat exposure and male fertility: a review. Hum Reprod. 1998, 13, 2122-5.
11. Slowikowska-Hilczer J. Xenobiotics with estrogen or antiandrogrn action – disruptors of the male reproductive system. CEJM. 2006, 3, 205-227.
12. Purvis K. and Christiansen E. Male infertility: current concepts. Ann Med. 1992, 24, 259-72.
13. De Celis R., Pedron-Nuevo N. and Feria-Velasco A. Toxicology of male reproduction in animals and humans. Arch Androl. 1996, 37, 201-18.
14. Agarwal A., Sharma R. K., Desai N. R., [et al.] Role of oxidative stress in pathogenesis of varicocele and infertility. Urology. 2009, 73, 461-9.
15. Tunc O., Bakos H. W. and Tremellen K. Impact of body mass index on seminal oxidative stress. Andrologia. 2011, 43, 121-8.
16. Halliwell B. Free radicals, antioxidants, and human disease: curiosity, cause, or consequence? Lancet. 1994, 344, 721-4.
17. Henkel R. and Schill W. B. Sperm separation in patients with urogenital infections. Andrologia. 1998, 30 Suppl 1, 91-7.
18. Sanocka-Maciejewska D., Ciupinska M. and Kurpisz M. Bacterial infection and semen quality. J Reprod Immunol. 2005, 67, 51-6.
19. Schuppe H. C., Meinhardt A., Allam J. P., [et al.] Chronic orchitis: a neglected cause of male infertility? Andrologia. 2008, 40, 84-91.
20. Cummins J. M., Jequier A. M. and Kan R. Molecular biology of human male infertility: links with aging, mitochondrial genetics, and oxidative stress? Mol Reprod Dev. 1994, 37, 345-62.
21. Zini A., San Gabriel M. and Baazeem A. Antioxidants and sperm DNA damage: a clinical perspective. J Assist Reprod Genet. 2009, 26, 427-32.
22. Aitken R. J., De Iuliis G. N., Finnie J. M., [et al.] Analysis of the relationships between oxidative stress, DNA damage and sperm vitality in a patient population: development of diagnostic criteria. Hum Reprod. 2010, 25, 2415-26.
23. Agarwal A., Nallella K. P., Allamaneni S. S., [et al.] Role of antioxidants in treatment of male infertility: an overview of the literature. Reprod Biomed Online. 2004, 8, 616-27.
24. Smith R., Vantman D., Ponce J., [et al.] Total antioxidant capacity of human seminal plasma. Hum Reprod. 1996, 11, 1655-60.
25. Lewis S. E., Sterling E. S., Young I. S., [et al.] Comparison of individual antioxidants of sperm and seminal plasma in fertile and infertile men. Fertil Steril. 1997, 67, 142-7.
26. Sanocka D., Miesel R., Jedrzejczak P., [et al.] Oxidative stress and male infertility. J Androl. 1996, 17, 449-54.
27. Agarwal A., Allamaneni S. S., Nallella K. P., [et al.] Correlation of reactive oxygen species levels with the fertilization rate after in vitro fertilization: a qualified meta-analysis. Fertil Steril. 2005, 84, 228-31.
28. Agarwal A. and Sekhon L. H. The role of antioxidant therapy in the treatment of male infertility. Hum Fertil (Camb). 2010, 13, 217-25.
29. Fisher H. M. and Aitken R. J. Comparative analysis of the ability of precursor germ cells and epididymal spermatozoa to generate reactive oxygen metabolites. J Exp Zool. 1997, 277, 390-400.
30. Gomez E., Buckingham D. W., Brindle J., [et al.] Development of an image analysis system to monitor the retention of residual cytoplasm by human spermatozoa: correlation with biochemical markers of the cytoplasmic space, oxidative stress, and sperm function. J Androl. 1996, 17, 276-87.
31. Aitken R. J., Fisher H. M., Fulton N., [et al.] Reactive oxygen species generation by human spermatozoa is induced by exogenous NADPH and inhibited by the flavoprotein inhibitors diphenylene iodonium and quinacrine. Mol Reprod Dev. 1997, 47, 468-82.
32. Aziz N., Saleh R. A., Sharma R. K., [et al.] Novel association between sperm reactive oxygen species production, sperm morphological defects, and the sperm deformity index. Fertil Steril. 2004, 81, 349-54.
33. de Lamirande E. and Gagnon C. Capacitation-associated production of superoxide anion by human spermatozoa. Free Radic Biol Med. 1995, 18, 487-95.
34. Plante M., de Lamirande E. and Gagnon C. Reactive oxygen species released by activated neutrophils, but not by deficient spermatozoa, are sufficient to affect normal sperm motility. Fertil Steril. 1994, 62, 387-93.
35. Fraczek M. and Kurpisz M. [The redox system in human semen and peroxidative damage of spermatozoa]. Postepy Hig Med Dosw (Online). 2005, 59, 523-34.
36. Peeker R., Abramsson L. and Marklund S. L. Superoxide dismutase isoenzymes in human seminal plasma and spermatozoa. Mol Hum Reprod. 1997, 3, 1061-6.
37. Wolski J. K. Rola mikroelementów i witamin w niepłodności męskiej. Przegl Urol. 2011, 4,
38. Park S., Park N. Y., Valacchi G., [et al.] Calorie restriction with a high-fat diet effectively attenuated inflammatory response and oxidative stress-related markers in obese tissues of the high diet fed rats. Mediators Inflamm. 2012, 2012, 984643.
39. Hogarth C. A. and Griswold M. D. The key role of vitamin A in spermatogenesis. J Clin Invest. 2010, 120, 956-62.
40. Kao S. H., Chao H. T., Chen H. W., [et al.] Increase of oxidative stress in human sperm with lower motility. Fertil Steril. 2008, 89, 1183-90.
41. de Lamirande E. and Gagnon C. Reactive oxygen species and human spermatozoa. I. Effects on the motility of intact spermatozoa and on sperm axonemes. J Androl. 1992, 13, 368-78.
42. Kessopoulou E., Powers H. J., Sharma K. K., [et al.] A double-blind randomized placebo cross-over controlled trial using the antioxidant vitamin E to treat reactive oxygen species associated male infertility. Fertil Steril. 1995, 64, 825-31.
43. Keskes-Ammar L., Feki-Chakroun N., Rebai T., [et al.] Sperm oxidative stress and the effect of an oral vitamin E and selenium supplement on semen quality in infertile men. Arch Androl. 2003, 49, 83-94.
44. Suleiman S. A., Ali M. E., Zaki Z. M., [et al.] Lipid peroxidation and human sperm motility: protective role of vitamin E. J Androl. 1996, 17, 530-7.
45. Boitani C. and Puglisi R. Selenium, a key element in spermatogenesis and male fertility. Adv Exp Med Biol. 2008, 636, 65-73.
46. Camejo M. I., Abdala L., Vivas-Acevedo G., [et al.] Selenium, copper and zinc in seminal plasma of men with varicocele, relationship with seminal parameters. Biol Trace Elem Res. 2011, 143, 1247-54.
47. Ursini F., Heim S., Kiess M., [et al.] Dual function of the selenoprotein PHGPx during sperm maturation. Science. 1999, 285, 1393-6.
48. Colagar A. H., Marzony E. T. and Chaichi M. J. Zinc levels in seminal plasma are associated with sperm quality in fertile and infertile men. Nutr Res. 2009, 29, 82-8.
49. Xu D. X., Shen H. M., Zhu Q. X., [et al.] The associations among semen quality, oxidative DNA damage in human spermatozoa and concentrations of cadmium, lead and selenium in seminal plasma. Mutat Res. 2003, 534, 155-63.
50. Mankad M., Sathawara N. G., Doshi H., [et al.] Seminal plasma zinc concentration and alpha-glucosidase activity with respect to semen quality. Biol Trace Elem Res. 2006, 110, 97-106.
51. Fraga C. G., Motchnik P. A., Shigenaga M. K., [et al.] Ascorbic acid protects against endogenous oxidative DNA damage in human sperm. Proc Natl Acad Sci U S A. 1991, 88, 11003-6.
52. Dawson E. B., Harris W. A., Teter M. C., [et al.] Effect of ascorbic acid supplementation on the sperm quality of smokers. Fertil Steril. 1992, 58, 1034-9.
53. Baker H. W., Brindle J., Irvine D. S., [et al.] Protective effect of antioxidants on the impairment of sperm motility by activated polymorphonuclear leukocytes. Fertil Steril. 1996, 65, 411-9.
54. Lenzi A., Picardo M., Gandini L., [et al.] Glutathione treatment of dyspermia: effect on the lipoperoxidation process. Hum Reprod. 1994, 9, 2044-50.
55. Irvine D. S. Glutathione as a treatment for male infertility. Rev Reprod. 1996, 1, 6-12.
56. Oeda T., Henkel R., Ohmori H., [et al.] Scavenging effect of N-acetyl-L-cysteine against reactive oxygen species in human semen: a possible therapeutic modality for male factor infertility? Andrologia. 1997, 29, 125-31.
57. Etensel B., Ozkisacik S., Ozkara E., [et al.] Dexpanthenol attenuates lipid peroxidation and testicular damage at experimental ischemia and reperfusion injury. Pediatr Surg Int. 2007, 23, 177-81.
58. Kapranos N., Petrakou E., Anastasiadou C., [et al.] Detection of herpes simplex virus, cytomegalovirus, and Epstein-Barr virus in the semen of men attending an infertility clinic. Fertil Steril. 2003, 79 Suppl 3, 1566-70.
59. Veznik Z., Pospisil L., Svecova D., [et al.] Chlamydiae in the ejaculate: their influence on the quality and morphology of sperm. Acta Obstet Gynecol Scand. 2004, 83, 656-60.
60. Gdoura R., Kchaou W., Znazen A., [et al.] Screening for bacterial pathogens in semen samples from infertile men with and without leukocytospermia. Andrologia. 2008, 40, 209-18.
61. Zitzmann M. The role of the CAG repeat androgen receptor polymorphism in andrology. Front Horm Res. 2009, 37, 52-61.
62. Safarinejad M. R., Shafiei N. and Safarinejad S. Association of polymorphisms in the estrogen receptors alpha, and beta (ESR1, ESR2) with the occurrence of male infertility and semen parameters. J Steroid Biochem Mol Biol. 2010, 122, 193-203.
63. Casarini L., Pignatti E. and Simoni M. Effects of polymorphisms in gonadotropin and gonadotropin receptor genes on reproductive function. Rev Endocr Metab Disord. 2011, 12, 303-21.
64. Carlsen E., Swan S. H., Petersen J. H., [et al.] Longitudinal changes in semen parameters in young Danish men from the Copenhagen area. Hum Reprod. 2005, 20, 942-9.
65. Skakkebaek N. E., Jorgensen N., Main K. M., [et al.] Is human fecundity declining? Int J Androl. 2006, 29, 2-11.
66. Dyrektywa Komisji Europejskiej 2008/100/WE z dnia 28 października 2008 r. Zmieniająca dyrektywę Rady 90/496/EWG w sprawie oznaczania wartości odżywczej środków
spożywczych w odniesieniu do zalecanego dziennego spożycia, współczynników przeliczeniowych energii oraz definicji. Dziennik Urzędowy Unii Europejskiej. 2008,
Z0BACZ TAKŻE

Hipertermia jąder indukuje stres oksydacyjny w nasieniu
Obserwowane od ponad 60 lat obniżenie parametrów nasienia i potencjału reprodukcyjnego mężczyzn spowodowane... Więcej →

Pogorszenie parametrów nasienia u górnika związane ze zmianą warunków pracy – opis przypadku
Powszechnie znany jest fakt, że podwyższona temperatura jąder jest czynnikiem negatywnie wpływającym na... Więcej →

Leczenie przeciwzapalne, przeciwbakteryjne, antyoksydacyjne oraz suplementacja diety pozytywnie wpływa na ruchliwość plemników u pacjentów z oligozoospermią i leukocytospermią.
Naukowcy z białostockiej kliniki przeprowadzili badania, wśród mężczyzn z nieprawidłowymi wynikami badań... Więcej →
