Wytyczne dla diagnostów: Badanie nasienia – standardy wg wytycznych WHO z 2010r., opracowane przez Komisję ds Konsensusu Lekarsko–Diagnostycznego PTA i PTDL
12 września 2011Poniżej prezentujemy wytyczne dla diagnostów laboratoryjnych co do wykonywania badania ogólnego nasienia zgodnie z rekomendacjami WHO z 2010 roku. Opis ten znalazł się także w magazynie: Diagnostyka laboratoryjna (Journal of Laboratory Diagnostics) 2010, Vol 46, Issue 2, p. 161-170
Przygotowanie Pacjenta do badania
- Każdy Pacjent powinien otrzymać ustną lub pisemną instrukcję odnośnie warunków oddania próbki nasienia do badania.
UWAGA!
Wszelkie informacje związane z badaniem nasienia powinny być przekazywane Pacjentowi w sposób poufny! - Zaleca się wykonanie badania nasienia po zachowaniu okresu wstrzemięźliwości płciowej (czas od ostatniego wytrysku nasienia) od 2 do 7 dni. Informacja o okresie abstynencji powinna znaleźć się na wyniku.
- W przypadkach kolejnego badania nasienia, Pacjent powinien zachować ten sam okres wstrzemięźliwości płciowej, jaki zachowany był przy pierwszym badaniu.
- Zalecane jest oddanie nasienia w pomieszczeniu w pobliżu laboratorium, w warunkach zapewniających intymność.
- Pojemniki, do których oddawane jest nasienie powinny być wydane przez laboratorium (zalecane pojemniki jednorazowe o objętości 60-130 ml).
- Nasienie należy oddać drogą masturbacji.
- Pojemnik z nasieniem należy opisać (imię i nazwisko lub kod Pacjenta).
- Nasienie powinno być oddane do pojemnika w całości, przy zachowaniu podstawowych zasad higieny. Jeśli nasienie nie zostało oddane w całości, Pacjent zobowiązany jest poinformować o tym personel medyczny.
- W przypadku problemów z oddaniem nasienia w laboratorium, dopuszczalne jest oddanie nasienia w warunkach domowych podczas stosunku płciowego do specjalnej prezerwatywy bez środków plemnikobójczych i dostarczenie materiału do badania w czasie nie przekraczającym 60 min. od oddania ejakulatu. Próbkę nasienia należy zabezpieczyć przed wychłodzeniem (transport w temp. 20-37°C ).
I. Procedura badania nasienia
Etapy wykonywania badania nasienia:
- W ciągu pierwszych 5 minut od ejakulacji
- – pojemnik z próbką nasienia odstawić na mieszadło rotacyjne (temp. pok. 20-25°C) lub umieścić w cieplarce (37°C) na okres potrzebny do upłynnienia
- Zaraz po upłynnieniu nasienia (najlepiej w czasie do 30 min., ale przed upływem 60 min. od ejakulacji)
- wpisanie do protokołu badania czasu upłynnienia (jeśli próbka nie upłynni się w przeciągu 30 min., odczekać z rozpoczęciem dalszych analiz kolejne 30 min.)
- ocena wyglądu
- ocena lepkości
- ocena objętości
- ocena pH
- przygotowanie preparatu bezpośredniego do oceny mikroskopowej próbki nasienia
- ocena ruchliwości plemników
- przygotowanie rozcieńczeń do oceny liczby plemników
- ocena żywotności
- przygotowanie rozmazów do oceny morfologii plemników
- ocena liczby plemników w komorze
- ocena komórek peroksydazo-pozytywnych (jeśli wymagane przez lekarza)
- wykonanie testu MAR (Mixed Antiglobulin Reaction) (jeśli wymagane przez lekarza)
- przygotowanie plemników do testu immunobead (jeśli wymagane przez lekarza)
- odwirowanie nasienia (jeśli jest wymagane przez lekarza oznaczenie parametrów biochemicznych w plazmie nasienia, lub w przypadku azoospermii)
- Po upływie 1 godziny od ejakulacji
- utrwalenie, wybarwienie rozmazów nasienia i ocena morfologii plemników
- Przed upływem 3 godzin od ejakulacji
- przesłanie próbki do badania mikrobiologicznego (jeśli wymagane przez lekarza)
- Później, ale tego samego dnia (lub następnego dnia po uprzednim zamrożeniu próbki)
- wykonanie badań związanych z czynnością gruczołów dodatkowych (jeśli wymagane przez lekarza)
- wykonanie pośredniego testu immunobead (jeśli wymagane przez lekarza)
Ocena makroskopowa nasienia
Ocena makroskopowa nasienia powinna zostać przeprowadzona zaraz po upłynnieniu się nasienia, najlepiej w czasie do 30 min. (oprócz oceny pH), jednak nie później niż w ciągu 60 min. od ejakulacji.
Czas upłynnienia
Upłynnienie nasienia następuje samoistnie w ciągu 60 min. od ejakulacji (zwykle – 15 min.). W trakcie upłynniania zaleca się umieszczenie pojemnika z próbką na mieszadle rotacyjnym (temp. pokojowa 20-25°C lub cieplarka 37°C). Upłynnienie ocenia się makroskopowo, w sytuacjach wątpliwych potwierdza się mikroskopowo. Czas upłynnienia podajemy w minutach. Jeśli upłynnienie nie nastąpi w ciągu 60 min., to na wyniku podajemy informację – upłynnienie >60 min. Czasami nasienie nie ulega upłynnieniu, powodując trudności w wykonaniu badania. Aby przeprowadzić dalsze badanie, należy poddać próbkę dodatkowej obróbce poprzez kilkukrotne zaaspirowanie (6-10 razy) ejakulatu do strzykawki z igłą o wewnętrznej średnicy od 0,69 do 0,84 mm, lub dodanie określonej objętości roztworu Dulbecco lub bromeliny (1g/l) i wymieszanie przy użyciu pipety Pasteura.
UWAGA! W tym przypadku przy dalszych obliczeniach należy uwzględnić rozcieńczenia nasienia. Zastosowanie ww. procedur musi zostać odnotowane na wyniku.
Objętość nasienia
Objętość wyrażana jest w ml – zalecana jest wagowa metoda pomiaru objętości.
W celu określenia objętości tą metodą należy:
a) zważyć pojemnik, do którego ma być oddane nasienie – x [g]
b) zważyć powtórnie pojemnik z nasieniem – y [g]
c) obliczyć wagę nasienia – z [g] z = y – x
Dokładność ważenia do 0,1 g
Przyjmując, że gęstość nasienia wynosi 1 g /ml (dokładnie 1.014 g/ml ) to [g] = [ml].
Wyliczona waga nasienia w [g] odpowiada objętości ejakulatu wyrażonej w [ml].
Druga metoda polega na pomiarze objętości w wyskalowanym cylindrze z dokładnością do 0,1 ml.
Barwa nasienia
Terminologia używana do określania barwy:
- prawidłowa: szaro-opalizująca, mleczno–szara, nieprzezroczysta
- nieprawidłowa: przezroczysta, żółtawa (żółtaczka, przyjmowane leki), czerwono-brunatna (domieszka krwi)
Lepkość nasienia
Lepkość nasienia określa się na podstawie długości kropli wypływającej z pipety o szerokim ujściu (jednorazowa pipeta Pasteura). W przypadku nieprawidłowej lepkości nasienie nie wypływa kroplami, ale tworzy nici o długości powyżej 2 cm.
Druga metoda: zanurzoną w nasieniu szklaną pałeczką podciągamy nasienie do góry. W przypadku nieprawidłowej lepkości tworzy się nitka długości powyżej 2 cm.
W celu zmniejszenia podwyższonej lepkości stosuje się takie same metody jak przy opóźnionym upłynnieniu lub braku upłynnienia (mechaniczne, enzymatyczne).
Terminologia używana do określania lepkości:
- prawidłowa
- zwiększona
pH nasienia
Należy je oznaczać po upłynnieniu nasienia, zawsze w jednakowym czasie, najlepiej po 30 min., lecz nie później niż 60 min. od ejakulacji przy użyciu papierków wskaźnikowych o zakresie pH 6,0 do 10,0.
Badanie mikroskopowe nasienia
Zaleca się używanie mikroskopu z kontrastem fazowym i zestawem obiektywów o powiększeniu 10x, 20x, 40x, 100x. Dopuszczalne jest badanie nasienia z zastosowaniem zwykłego mikroskopu świetlnego.
Badanie mikroskopowe nasienia rozpoczynamy zaraz po upłynnieniu próbki, najlepiej w czasie do 30 min., jednak nie później niż w ciągu 60 min. od ejakulacji.
Jeśli upłynnienie nie nastąpiło w przeciągu 60 min. próbka powinna być poddana dodatkowej obróbce (mechanicznej lub enzymatycznej). Fakt ten należy odnotować na wyniku.
Przygotowanie preparatu bezpośredniego:
Przed każdorazowym pobraniem próbki do oceny mikroskopowej nasienie należy bardzo starannie, ale delikatnie wymieszać, unikając tworzenia się pęcherzyków powietrza. Do mieszania polecana jest jednorazowa pipeta Pasteura o szerokim ujściu (1,5 mm), którą należy delikatnie zaaspirować próbkę około 10 razy. Nie wolno stosować wytrząsarki, ponieważ powoduje uszkodzenie plemników. Następnie, przy użyciu pipety automatycznej należy nanieść 10 µl nasienia na szkiełko podstawowe, przykryć szkiełkiem nakrywkowym o wymiarach 22 x 22 mm unikając tworzenia się pęcherzyków powietrza. Tak przygotowany preparat pozostawić na ok. 1 minutę w temp. 20-25°C lub 37°C, a następnie poddać ocenie mikroskopowej.
Temperaturą z wyboru do oceny nasienia jest temp. 37°C, jednak ocenę ruchu można przeprowadzać również w temp. pokojowej tj. 20-25°C.
Wstępna ocena mikroskopowa preparatu bezpośredniego
I. powiększenie całkowite 100x (okular 10x i obiektyw 10x)
- występowanie pasm śluzu
- ocena nieprawidłowości w zachowaniu się plemników (agregacja, aglutynacja)
- obecność innych elementów morfotycznych
II. powiększenie całkowite 200x / 400x
- ocena ruchliwości plemników
- ustalenie rozcieńczenia próbki nasienia do oceny koncentracji plemników (liczba plemników wyrażona w mln/ml nasienia)
Ocena preparatu bezpośredniego
Ocena nieprawidłowości w zachowaniu się plemników
Niespecyficzną agregację obserwujemy, gdy zarówno nieruchome jak i ruchome plemniki przylegają do siebie oraz do pasm śluzu, innych komórek lub do ciałek resztkowych tworząc skupiska.
Aglutynację obserwujemy gdy ruchome plemniki przylegając do siebie tworząc skupiska – zjawisko dotyczy tylko plemników.
Aglutynacja określana jest w stopniach od 1 do 4:
- stopień 1 – <10 plemników tworzących skupiska, wiele plemników wolnych
- stopień 2 – od 10 do 50 plemników tworzących skupiska, obecne wolne plemniki
- stopień 3 – >50 plemników w skupiskach, obecne pojedyncze wolne plemniki
- stopień 4 – wszystkie plemniki tworzą skupiska, poszczególne skupiska łączą się ze sobą.
Obecność innych elementów morfotycznych
W preparacie bezpośrednim wymienione poniżej elementy morfotyczne oceniane są wg oceny szacunkowej:
- ciałka resztkowe
- bakterie
- nabłonki
- kryształy sperminy
Używana terminologia:
- pojedyncze, nieliczne, dość liczne, liczne, bardzo liczne w polu widzenia lub w preparacie
Komórki okrągłe w nasieniu
W nasieniu mogą znajdować się leukocyty oraz komórki spermatogenezy określane wspólnie jako „komórki okrągłe”. Koncentrację komórek okrągłych (liczba komórek wyrażona w mln/ml ejakulatu) liczymy metodą komorową podczas określania koncentracji plemników. Inna zalecana technika polega na wykonaniu rozmazu na szkiełku podstawowym i zabarwieniu go metodą Papanicolau, zestawem Diff-Quick lub May-Grunwald-Giemzy (MGG).
UWAGA! Preparat wybarwiony metodą MGG nie może być wykorzystywany do oceny morfologii plemników.
Elementy komórkowe oceniamy pod immersją (powiększenie 1000x) w mikroskopie. Do obliczenia wartości bezwzględnych stosuje się odpowiedni wzór:
C = (n x S) /100
C – koncentracja komórek spermatogenezy i leukocytów – w mln/ml ejakulatu
n – liczba policzonych komórek spermatogenezy i leukocytów przypadających na 100 plemników
S – koncentracja plemników wyrażona w mln/ml ejakulatu
Jeśli koncentracja komórek okrągłych będzie >=1 mln/ml zaleca się wykonanie dodatkowych procedur w celu określenia koncentracji leukocytów peroksydazo-dodatnich.
Ocena ruchliwości plemników
Ruch plemników klasyfikuje się według następującej skali (klasyfikacja WHO 2010):
- ruch postępowy – plemniki poruszające się ruchem postępowym zarówno liniowym, jak i po dużym okręgu bez względu na ich szybkość
- ruch niepostępowy- plemniki poruszające się ruchem niepostępowym (w miejscu i po małym okręgu)
- plemniki nieruchome
Oceny dokonuje się w dwóch preparatach bezpośrednich wykonanych z tego samego ejakulatu. W danym polu widzenia jako pierwsze liczy się plemniki poruszające się ruchem postępowym, a następnie w tym samym polu ocenia się plemniki o ruchu niepostępowym oraz plemniki nieruchome. W celu oceny i klasyfikacji ruchu obserwacji poddaje się plemniki przynajmniej w 5 polach widzenia, przy czym ocenia się nie mniej niż 200 plemników w jednym preparacie. Przy ocenie ruchu należy pamiętać, aby w ostatnim polu widzenia ocenić ruch wszystkich plemników, nawet jeśli wcześniej przekroczona została liczba 200 ocenionych plemników. Ruch wyraża się jako odsetek (%) plemników o danym typie ruchu, wynik zaokrąglając do liczby całkowitej. Wynik podaje się jako średnią z dwóch wyników uzyskanych z oceny ruchu w dwóch preparatach po zweryfikowaniu różnicy z poszczególnych zliczeń. W celu zweryfikowania dopuszczalnej różnicy pomiędzy wynikami uzyskanymi z obu preparatów należy porównać wynik reprezentujący najliczniejszą kategorię ruchu (Tab. 5).
W przypadkach niezgodności co do różnicy wynikającej z tabeli 5 liczenie musi być wykonane w całości od początku – od wykonania preparatu bezpośredniego.
Przykład: W wyniku dwukrotnego zliczenia 200 plemników uzyskano wyniki: ruch postępowy – 30% i 50%; ruch niepostępowy – 5% i 15% oraz plemniki nieruchome – 65% i 35%. Najliczniejszą kategorię ruchu reprezentowały plemniki nieruchome, ich średni wynik to 50% a różnica pomiędzy nimi wynosi 30%. Z tabeli 5 wynika że dla wartości 50% dopuszczalna różnica pomiędzy wynikami wynosi 10%. W takiej sytuacji analizę należy powtórzyć, przygotowując nowe preparaty.
Ustalenie rozcieńczenia do oceny koncentracji plemników
W celu ustalenia odpowiedniego rozcieńczenia próbki nasienia do oceny koncentracji plemników (liczba plemników wyrażona w mln/ml nasienia) wykonuje się ocenę liczby plemników w polu widzenia pod całkowitym powiększeniem 200x lub 400x (Tab. 1).
Do wykonania rozcieńczeń zalecane jest używanie automatycznych pipet tłokowych (ang. positive-displacement pipette) oraz aspirowanie objętości nasienia nie mniejszej niż 50 µl. Należy pamiętać o dokładnym i delikatnym wymieszaniu próbki tuż przed wykonaniem rozcieńczeń. Wykonujemy dwa takie same rozcieńczenia.
Jako rozcieńczalnika używa się roztworu hipertonicznego. Zalecany rozcieńczalnik:
50 g NaHCO3
10 ml 35% Formalina (v/v)
Dobrze wymieszać i uzupełnić wodą destylowaną do 1000 ml
(Trwałość roztworu w temp. 4 °C – 12 miesięcy)
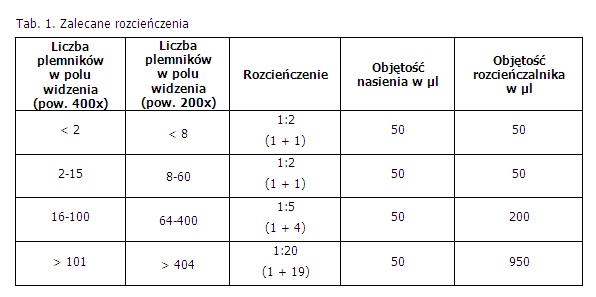
Tabela zalecane rozcieńczenia
Ocena koncentracji plemników
Terminy „całkowita liczba plemników” oraz „koncentracja plemników” nie są synonimami. Termin „koncentracja plemników” odnosi się do liczby plemników w jednostce objętości nasienia (1 ml), podczas gdy „całkowita liczba plemników” odnosi się do liczby plemników w całej objętości ejakulatu i wylicza się ją mnożąc koncentrację plemników przez objętości ejakulatu.
Do liczenia plemników zalecane jest używanie kamer o głębokości 100 µm lub głębszych. Zaleca się przeprowadzanie procedury oceny koncentracji plemników w udoskonalonej komorze Neubauera (ang. improved Neubauer haemocytometer) (Ryc. 1).
Udoskonalona komora Neubauera posiada dwie oddzielne komory zliczeniowe (o rozmiarach 3×3 mm). Każda z komór podzielona jest na 9 siatek o rozmiarach 1×1 mm. Siatki nr 1,3,7,9 zawierają 4 rzędy po 4 duże kwadraty. Siatki nr 2 i 8 zawierają 4 rzędy po 5 dużych kwadratów. Siatki nr 4 i 6 zawierają 5 rzędów po 4 duże kwadraty. Środkowa siatka nr 5 zawiera 5 rzędów po 5 dużych kwadratów.
Komorę przykrywa się szkiełkiem nakrywkowym o określonej grubości (0.44 mm).
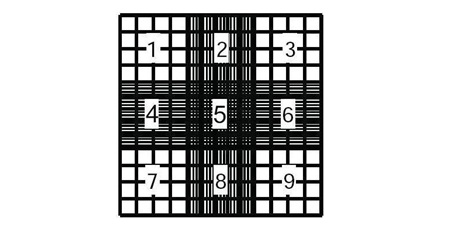
Jedna z dwóch komór zliczeniowych w udoskonalonej komorze Neubauera z zaznaczonymi 9 siatkami.
Przy głębokości 100 mm, nad każdą z 9 siatek znajduje się 100 nl rozcieńczonej próbki nasienia. Objętość próbki nasienia znajdująca się nad jednym kwadratem oraz jednym rzędem w poszczególnych siatkach komory przedstawiona jest w tabeli 2.
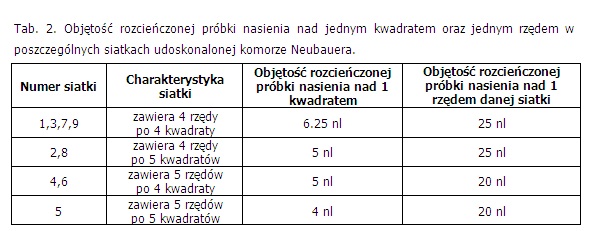
Objętość rozcieńczonej próbki nasienia nad jednym kwadratem oraz jednym rzędem w poszczególnych w poszczególnych siatkach udoskonalonej komorze Neubauera
Jedno z dwóch przygotowanych wcześniej rozcieńczeń wprowadza się nad jedną z komór, drugie nad drugą, po uprzednim dokładnym wymieszaniu. Liczenie przeprowadza się w obu komorach (zachowując regułę 2 boków B?rkera). Zaleca się zliczenie co najmniej 400 plemników z dwóch zliczeń (dwóch komór zliczeniowych w komorze), każde po około 200 plemników. Zliczamy tylko kompletne plemniki (z główką i witką).
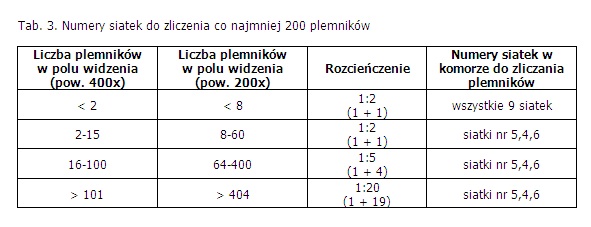
Tabela 3 przedstawia numery odpowiednich siatek w jednej komorze udoskonalonej komory Neubauera potrzebne do zliczenia co najmniej 200 plemników, w zależności od ilości plemników obserwowanych w polu widzenia w preparacie bezpośrednim i wykonanego rozcieńczenia.
Liczenie rozpoczyna się zawsze od zliczania plemników w poszczególnych rzędach w siatce nr 5. Jeśli nie zliczymy 200 plemników po obejrzeniu wszystkich 5 rzędów siatki nr 5, kontynuujemy zliczanie w poszczególnych rzędach (każde po 4 kwadraty) w przyległych siatkach (siatki nr 4 i 6), aż do zliczenia co najmniej 200 plemników. Jeśli osiągnięto liczbę 200 plemników w połowie rzędu, należy kontynuować zliczanie plemników do końca danego rzędu.
Zliczenie plemników w drugiej komorze wykonujemy tylko w tych samych rzędach poszczególnych siatek, nawet jeśli nie zliczymy 200 plemników.
Jeśli nie zliczy się 200 plemników w siatkach nr 4,5 i 6 to należy przygotować dwa niższe rozcieńczenia i przeprowadzić analizę powtórnie.
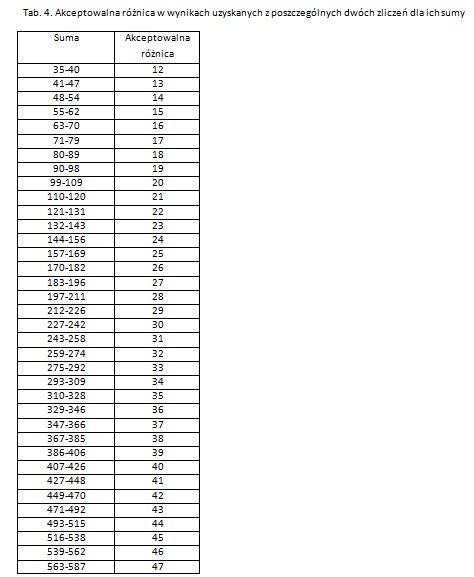
Po zweryfikowaniu różnicy (Tab. 4 ) z poszczególnych zliczeń, dokonujemy obliczenia wyniku wg wzorów lub powtarzamy cały cykl liczenia od początku:
1. rozcieńczenie 1+1 (1:2) i zliczanie plemników w rzędach siatek nr 4,5,6
C=(N/n)x(1/20)x2=(N/n)x(1/10)
2. rozcieńczenie 1+4 (1:5) i zliczanie plemników w rzędach siatek nr 4,5,6
C=(N/n)x(1/20)x5=(N/n)x(1/4)
3. rozcieńczenie 1+19 (1:20) i zliczanie plemników w rzędach siatek nr 4,5,6
C=(N/n)x(1/20)x20=(N/n)
4. rozcieńczenie 1+49 (1:50) i zliczanie plemników w rzędach siatek nr 4,5,6
C=(N/n)x(1/20)x50=(N/n)x2.5
gdzie N= suma zliczonych plemników z obu komór
n= suma rzędów z siatek nr 4,5,6, w których zliczano plemniki w obu komorach
Wynik otrzymujemy w mln/ml.
Postępowanie przy małej ilości plemników w preparacie bezpośrednim
Jeśli w preparacie bezpośrednim, pod powiększeniem 400x w polu widzenia było mniej niż 4 plemniki to szacunkowo zakłada się, że koncentracja plemników wynosi <1 mln/ml nasienia. Jeśli obserwowano mniej niż 2 plemniki w polu widzenia w preparacie, to szacunkowo zakłada się, że koncentracja plemników wynosi < 0.5 mln/ml nasienia.
W sytuacji, gdy badanie nasienia jest wykonywane jako badanie standardowe i nie ma potrzeby dokładnego obliczania koncentracji plemników z użyciem komory, dopuszcza się umieszczenie w wyniku badania szacunkowo zakładanej koncentracji plemników.
W sytuacjach, gdy określenie dokładnej koncentracji plemników jest wymagane, przygotowuje się dwa rozcieńczenia próbki 1:2 (1+1) i dokonuje się zliczania plemników w poszczególnych siatkach komór udoskonalonej komory Neubauera, zaczynając od siatki nr 1, aż do zliczenia co najmniej 200 plemników. Jeśli osiągnięto liczbę 200 plemników w połowie siatki, należy kontynuować zliczanie plemników do końca danej siatki.
Zliczanie powtarza się z drugiego rozcieńczenia, w drugiej komorze zliczając plemniki z tych samych siatek, z jakich były zliczane wcześniej, nawet jeśli nie osiągnięta została liczba 200 plemników.
Po zweryfikowaniu różnicy z poszczególnych zliczeń (Tab. 4), dokonujemy obliczenia wyniku wg wzoru:
C=(N/n)x(1/100)x2=(N/n)x(1/50)
gdzie N= suma zliczonych plemników z obu komór
n= suma siatek, w których zliczano plemniki w obu komorach.
Wynik otrzymujemy w mln/ml.
Jeśli w preparacie bezpośrednim nie znaleziono plemników, należy próbkę odwirować (15 min. 3000xg). Osad rozprowadzamy na szkiełku podstawowym, przykrywamy szkiełkiem nakrywkowym i oglądamy cały preparat w poszukiwaniu plemników. Jeśli nie znaleziono żadnego plemnika, w wyniku wpisujemy azoospermia (brak plemników w ejakulacie). Jeśli w osadzie znaleziono pojedyncze plemniki, w wyniku wpisujemy kryptozoospermia.
Ocena żywotności plemników
Badanie odsetka żywych plemników ocenia się poprzez identyfikację plemników z nienaruszoną integralnością błony komórkowej. Ocenę można wykonywać rutynowo we wszystkich próbkach nasienia, jednak wymagane jest jej wykonanie w próbkach, gdzie ruch postępowy plemników był poniżej wartości referencyjnych (tzn. < 40% plemników poruszających się ruchem postępowym).
Ocena żywotności plemników powinna być wykonana zaraz po upłynnieniu próbki, najlepiej w czasie do 30 min., jednak nie później niż w ciągu 60 min. od ejakulacji.
Zalecane testy oceny żywotności plemników:
a. test eozyna-nigrozyna
b. przyżyciowy test eozynowy
c. test pęcznienia plemników (HOS test, ang. hypo-osmotic swelling test)
Test eozyna-nigrozyna oraz przyżyciowy test eozynowy opierają się na zasadzie przepuszczalności błony komórkowej martwego plemnika dla barwnika. Nigrozyna jest używana do podbarwiania tła co ułatwia różnicowanie. Plemniki żywe nie absorbują eozyny i pozostają niezabarwione, plemniki martwe natomiast barwią się na czerwono, lub ciemno-różwo. Liczymy po 200 plemników, w dwóch powtórzeniach, różnicując je na żywe i martwe. Wynik podaje się jako średnią z dwu wyników uzyskanych z oceny w dwóch preparatach po zweryfikowaniu różnicy z poszczególnych zliczeń (Tab. 5).
Odsetek plemników nie zabarwionych (żywych) nie powinien być mniejszy niż odsetek plemników ruchomych.
Test HOS (Hypo-osmotic swelling test) tzw. test pęcznienia jest metodą alternatywną do przedstawionych metod barwnych. Plemniki z nienaruszoną błoną komórkową (żywe) zawieszone w hipoosmotycznym medium „pęcznieją” po 5 min. (zmiana wyglądu witki).Test ten powinien być wykonywany w laboratoriach specjalistycznych.
Ocena morfologii plemników
Morfologię plemników oceniamy w mikroskopie świetlnym pod imersją, przy powiększeniu 1000x, po uprzednim zabarwieniu rozmazu wykonanego z upłynnionego i dobrze wymieszanego nasienia. Zalecane barwienie metodą Papanicolaou (hematoksylina Harrisa, oranż G6, EA 50), Shorr’a lub z wykorzystaniem zestawu barwiącego Diff-Quick. Liczymy po 200 plemników, w dwóch powtórzeniach, z dwóch różnych preparatów wykonanych z tej samej próbki, różnicując je na prawidłowe i nieprawidłowe. Wynik podaje się jako średnią z wyników uzyskanych z oceny morfologii plemników w dwóch rozmazach po zweryfikowaniu różnicy z poszczególnych zliczeń (Tab. 5).
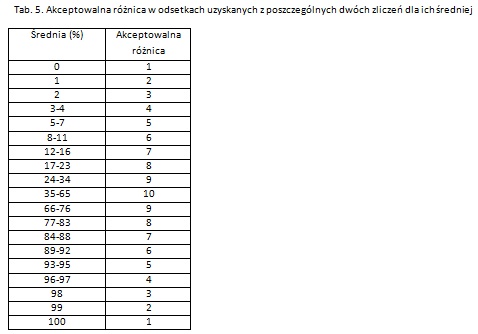
Akceptowalna różnica w odsetkach uzyskanych z poszczególnych dwóch zliczeń dla ich średiej.
W badaniu ocenia się budowę główki, części pośredniej (szyjka i wstawka) i witki (część główna oraz końcowa).
- Główka powinna być regularna w zarysie, o kształcie owalnym z dobrze widocznym regionem akrosomalnym zajmującym od 40 do 70% powierzchni główki. Region akrosomalny może zawierać nie więcej niż dwie wakuole, zajmujące do 20% powierzchni główki. Region poniżej akrosomu nie może zawierać żadnej wakuoli.
- Wstawka powinna być regularna w zarysie, o długości odpowiadającej długości główki. Oś wstawki powinna być przedłużeniem osi głównej główki. Przywieszka cytoplazmatyczna, jeśli obecna, nie powinna przekraczać 1/3 wielkości główki.
- Witka powinna mieć ok. 45 mm długości (tj. 10 długości główki), powinna być cieńsza niż wstawka, o jednakowej grubości na całej długości (część końcowa witki jest zwężona). Dopuszczalne są łagodne zgięcia witki, nie wskazujące na jej złamanie (zgięcia pod ostrym kątem).
Plemnik uznajemy za nieprawidłowy, gdy występuje zaburzenie któregokolwiek elementu budowy plemnika.
Zalecana jest klasyfikacja według Krugera (Kruger Strict Criteria). Jeżeli do oceny budowy użyto klasyfikacji wg Krugera to należy tą informację napisać na wyniku.
Wartości referencyjne dla parametrów nasienia wg WHO 2010 zostały przedstawione w tabeli 6, a międzynarodowe nazewnictwo klasyfikacji zaburzeń przy badaniu nasienia w tabeli 7.
Złączono także przykładowy wzór wyniku badania nasienia: Badanie nasienia wzór
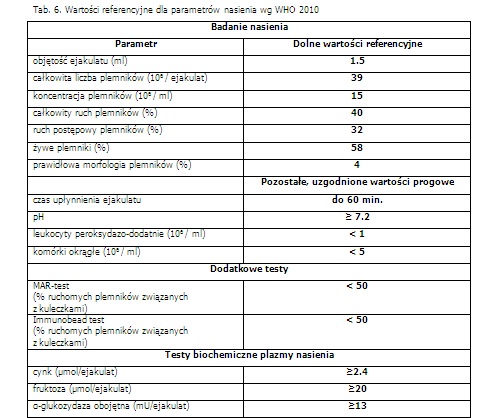
Wartości referencyjne dla parametrów nasienia WHO 2010
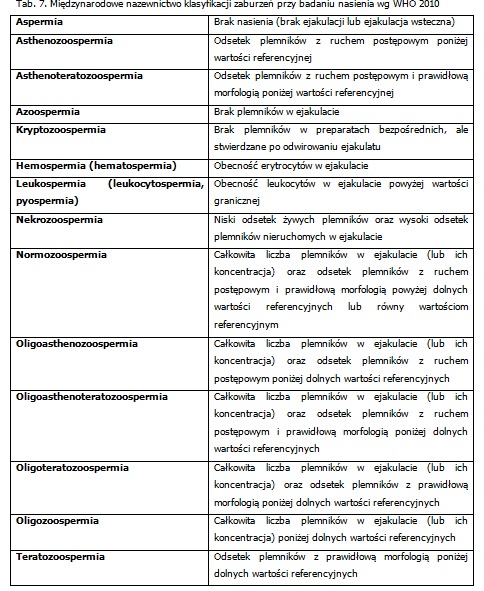
Międzynarodowe nazewnictwo kwalifikacji zaburzeń przy badaniu nasienia wg WHO 2010
Opracowanie:
Przewodniczący:
dr med. Leszek Bergier, DIAGNOSTYKA Spółka z o. o., Spółka komandytowa, Kraków (PTA, PTDL) *
Członkowie:
dr med. Szymon Bakalczuk, OVUM Rozrodczość i Andrologia, Lublin (PTA)
dr med. Stanisław Frącki, I Katedra i Klinika Położnictwa i Ginekologii, Uniwersytet Medyczny, Warszawa (PTA)
dr n. med. Katarzyna Marchlewska, Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny, Łódź (PTA)
dr hab. n. med. Małgorzata Piasecka, Samodzielna Pracownia Histologii i Biologii Rozwoju. Pomorska Akademia Medyczna, Szczecin (PTA)
dr n. med. Grażyna Taszarek-Hauke, Pracownia Andrologii, Szpital Kliniczny, Uniwersytet Medyczny, Poznań (PTDL)
dr n. med. Renata Walczak- Jędrzejowska , Zakład Andrologii, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny, Łódź (PTA)
mgr Jadwiga Wojtasik, DIAGNOSTYKA Spółka z o. o., Spółka komandytowa, Kraków (PTDL)
mgr Ewa Zagocka, Dział Diagnostyki Laboratoryjnej, Państwowy Szpital Kliniczny nr 1, Wrocław (PTA, PTDL)
*Adres do korespondencji:
dr med. Leszek Bergier
DIAGNOSTYKA Spółka z o. o., Spółka komandytowa
ul. Olszańska 5
31-513 Kraków
tel. 012 295-01-00 fax. 012 295-01-02
Opracowano na podstawie:
WHO laboratory manual for examination and processing of human semen. Fifth Edition. Prepublication version. 2010 r.
http://www.who.int/reproductivehealth/publications/infertility/9789241547789/en/index.html
Opracowanie opublikowano w:
Diagnostyka laboratoryjna (Journal of Laboratory Diagnostics) 2010, Vol 46, Issue 2, p. 161-170